HPLC方法开发之分离度,不止1.5!!!
对于色谱工作者而言,面对复杂成分的检测,分离是首要的关注点。无法有效分离意味着无法进行准确的定性、定量检测。
说起分离,有必要再介绍一下色谱。了解、理解并掌握色谱分离原理很重要,对于大多数接触了色谱分离的人而言,应该了解的基于不同分离原理的主要色谱技术包括吸附色谱、分配色谱、离子交换色谱、亲和色谱、大孔吸附树脂、凝胶色谱等。如果说上面这一系列名词还稍显陌生,那么根据分离方法所分类的纸色谱法、薄层色谱法、柱色谱法、气相色谱法、高效液相色谱法等,应该更广为熟知了。
无论是何种分离色谱,对于目标成分的分离均有相应要求。以中国药典通则0500色谱法项下的相关描述为例,薄层色谱中要求“除另有规定外,分离度应大于1.0”,高效液相色谱法、离子色谱法及气相色谱法等要求“除另有规定外,待测物质色谱峰与相邻色谱峰之间的分离度应不小于1.5”,分子排阻色谱法中要求“除另有规定外,分离度应大于2.0”。
从上述要求中可以直观的看出,不同色谱技术对于分离度的要求不尽相同,至于个中缘由我们暂不揣度。只是有一点很重要:分离度不是指导原则等文件规定死的一个参数,正如大多技术参数一样,始终是为了满足使用目的而进行的“私人订制”,量后裁!
本文主要以高效液相色谱法为例,抛砖引玉谈一下系统适用性中“分离度”这个参数,以期对该参数有一个更为深入的思考和认知,其中的案例也希望能给实际工作一些借鉴。

|
|
|
|
|
|
|
|
|
|
|
|
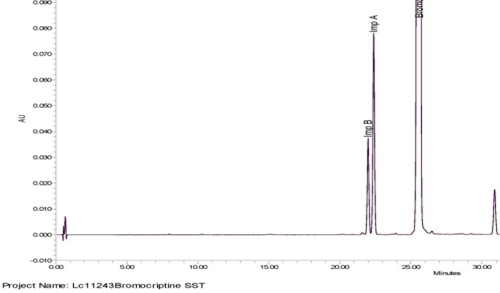
三、分离度小结
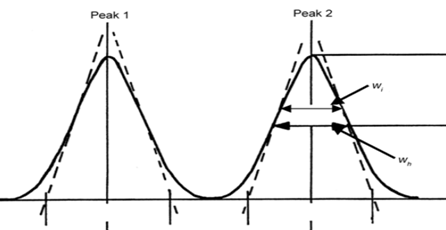
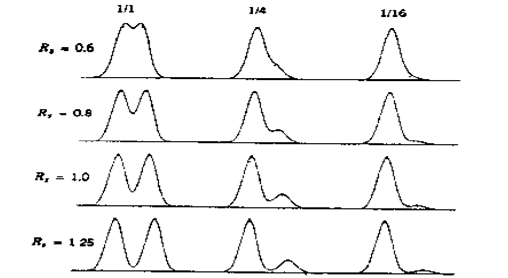
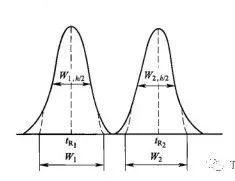
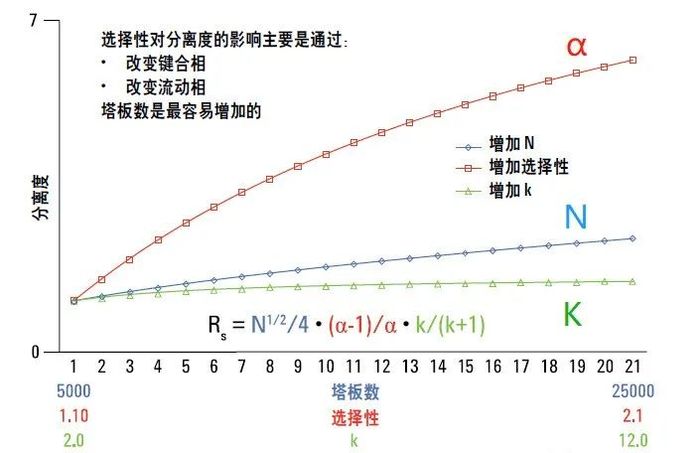
☏色谱知识:分离度是于评价待测物质与被分离物质之间的分离程度,一般待测物质色谱峰与相邻色谱峰之间的分离度应不小于 1.5。计算公式如下图,但改善分离度不与这些相关,而是与柱效N,保留因子k,选择因子α相关。

☏图例讲解:让K保留在1-10范围内,并让两个组分的α在1.1以上,在无法改进k的情况下,提高柱效N。
☏应用场景:1-8个组分,部分组分间分离度太小,未获得有效分离。
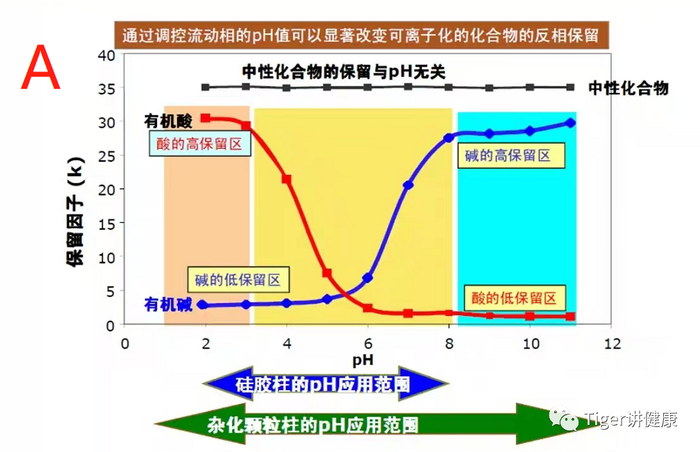
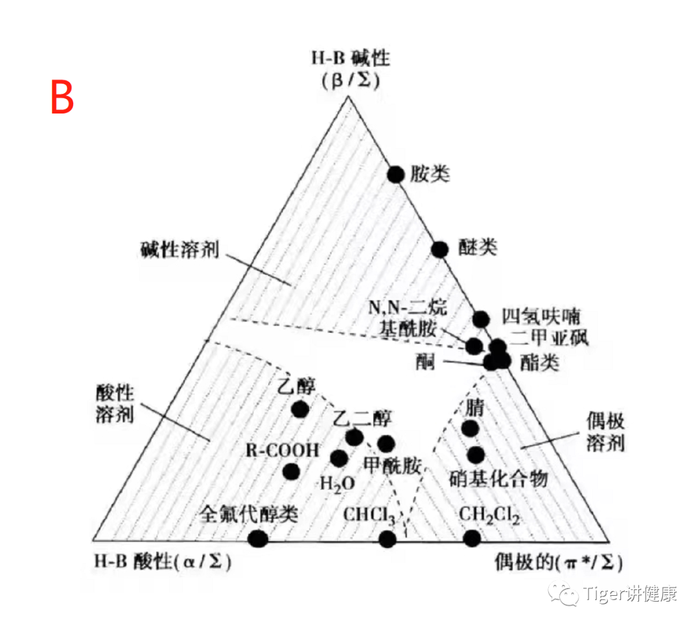
☏解决措施:①分析1-8个组分属于什么类型结构,具有什么官能团,什么极性,PKa值都是多少等;②根据组分性质,选择能区分组分的固定相和流动相,如氨基柱,氰基柱、硅胶柱等,乙腈/甲醇-缓冲盐等;③选择大多数组分K在1-10的色谱柱;④如果色谱峰峰形不好,就调节流动相PH值(见A图);如果分离度不好,就调节流动相种类或梯度(见B图)。
分析与GMP
展源
何发
相关文章
-

HPLC的应用以及方法开发
2020-05-27
-

HPLC分析方法开发经验分享
2023-06-16
-

选对色谱柱,快速开发方法
2020-05-27
-

HPLC方法开发典型思路经验小结
2021-05-18
-

HPLC检测器,你了解吗?
2024-03-06
-

HPLC方法开发典型思路经验小结!
2022-09-30
-

HPLC方法开发中色谱柱如何选择
2023-09-21
-

HPLC方法开发典型思路经验小结!!
2023-08-21
-

干货分享:HPLC分析方法开发经验分享
2023-12-14
-

AAS法分析茶叶中的铅,镉,砷
2020-05-27

加载更多