快讯!NMPA通过优先审评审批程序附条件批准2药品上市!
展源
2023-11-15
11月8日,NMPA官网连续发布2则药物批准上市讯息,均是通过优先审评审批程序附条件批准。
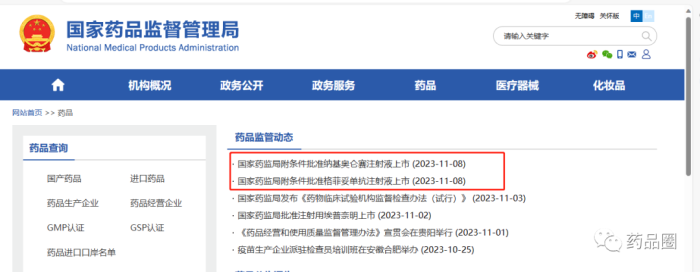
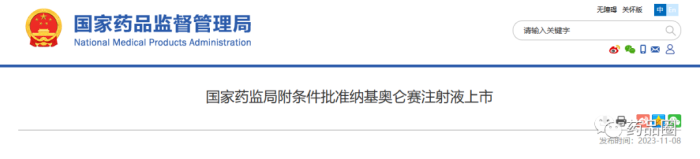
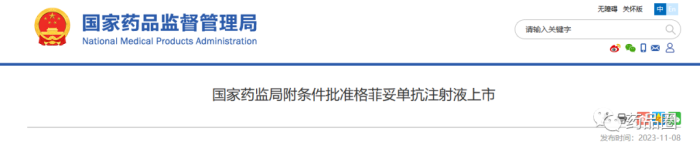
药品圈
展源
何发
热点文章
-
一文看懂测量不确定度
2024-09-04
-
分光光度法基本原理及应用
2024-08-05
-
各种缓冲溶液的配制方法大全
2024-10-15
-
GB/T 5750-2023《生活饮用水标准检验方法》系列标准
2024-09-02
-
MTT实验IC50,GI50,EC50还傻傻分不清楚?
2024-08-06
-
【收藏】六个快速查找抗体的神仙网站
2024-08-14
-
【小技巧】说说抽滤那些事儿
2024-09-14
-
洞察未来,共谋发展 “ 数·智·未来 ” 安捷伦未来实验室媒体圆桌会成功举办
实验室是科技创新的基础条件和成果产出源泉。十四五以来,国家着力打造战略科技力量,推进国家实验室建设和国家重点实验室体系重组,数字化、智能化、自动化赋能生物科技快速发展,掀起了科研领域创新变革的浪潮。
作者:展源
-
食品检验理化常用国家标准与要点
-
水分测定方法开发研究&检测相关问题故障分析解决解读
-
药物常用的晶型表征方法









评论
加载更多